Cambridge.
Un equipo científico ha desarrollado «miniplacentas» en el laboratorio y las ha utilizado para esclarecer cómo se desarrolla la placenta e interactúa con el revestimiento interno del útero, lo que podría ayudar a comprender mejor la preeclampsia y, en el futuro, a tratarla.
El estudio, publicado este miércoles en Cell Stem Cell, demuestra que es posible experimentar con una placenta humana en desarrollo, en lugar de limitarse a observar especímenes, para estudiar los principales trastornos del embarazo.
El éxito del embarazo depende del desarrollo de la placenta en las primeras semanas de gestación. Durante ese período, la placenta se implanta en el endometrio, el revestimiento mucoso del útero de la madre, se explica en un comunicado de la Universidad de Cambridge.
Las interacciones entre las células del endometrio y las de la placenta son decisivas para su éxito. En particular, son esenciales para aumentar el riego sanguíneo materno a la placenta, necesario para el crecimiento y desarrollo del feto.
Cuando estas interacciones no funcionan correctamente, pueden provocar complicaciones, como la preeclampsia, una enfermedad que provoca hipertensión durante el embarazo; esta se da en unos seis de cada 100 primeros embarazos y puede poner en peligro la salud de la madre y el bebé. miniplacentas
A pesar de que afecta a millones de mujeres al año en el mundo, aún se entiende poco. Suele presentarse al final del embarazo, pero para entenderla realmente -predecirla y prevenirla- hay que fijarse en lo que ocurre en las primeras semanas, subraya la universidad.
Ashley Moffett, del departamento de Patología de Cambridge, recuerda que la mayoría de los principales trastornos, como preeclampsia, mortinatalidad o retraso del crecimiento, dependen de fallos en la forma en que se desarrolla la placenta en las primeras semanas.
Se trata, añade, de un proceso increíblemente difícil de estudiar: el período posterior a la implantación, cuando la placenta se incrusta en el endometrio, suele describirse como una «caja negra del desarrollo humano».
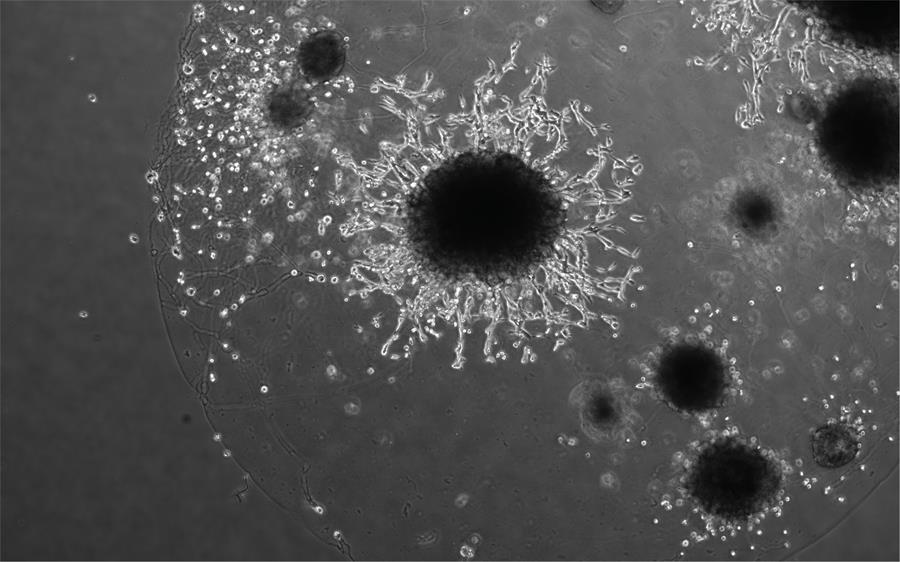
Moffett e investigadores del Instituto Friedrich Miescher (Suiza) y del Instituto Wellcome Sanger utilizaron «miniplacentas», un modelo celular de las primeras fases de la placenta, para obtener una visión del embarazo precoz y mejorar la comprensión de los trastornos reproductivos.
Conocidas como «organoides de trofoblasto», se cultivan a partir de células placentarias (los organoides son versiones milimétricas en 3D de órganos humanos que se fabrican, mediante métodos de cultivo celular, en laboratorio).
En trabajos anteriores, el equipo identificó genes que aumentan el riesgo de padecer enfermedades como la preeclampsia o protegen contra ellas.
Estos estudios pusieron de relieve el importante papel de las células inmunitarias exclusivas del útero, conocidas como «células asesinas naturales uterinas»; estas se agrupan en el revestimiento del útero, en el lugar donde se implanta la placenta.
En su nuevo estudio, el equipo aplicó proteínas secretadas por esas células asesinas a los organoides para que pudieran imitar las condiciones en las que se implanta la placenta.
Los científicos identificaron proteínas concretas que eran cruciales para ayudar a los organoides a desarrollarse. Estas contribuyen al éxito de la implantación, permitiendo que la placenta invada el útero y transforme las arterias de la madre.
«Si las células no son capaces de invadir correctamente, las arterias del útero no se abren y la placenta, y por tanto el bebé, no reciben nutrientes ni oxígeno, por eso surgen problemas más adelante», apunta la investigadora.
La descripción de esta técnica se publicó ya en 2018, también en Nature; ahora los científicos han dado a conocer nuevos datos, han identificado otras proteínas y han hecho pruebas con algunas.
- La IA marca un cambio en el vocabulario de artículos biomédicos - julio 3, 2025
- ‘Pedro Páramo’ y ‘La cocina’ lideran las nominaciones de los premios Ariel 2025 - julio 3, 2025
- «Éxito» en pruebas del taxi aéreo en Dubái - julio 1, 2025