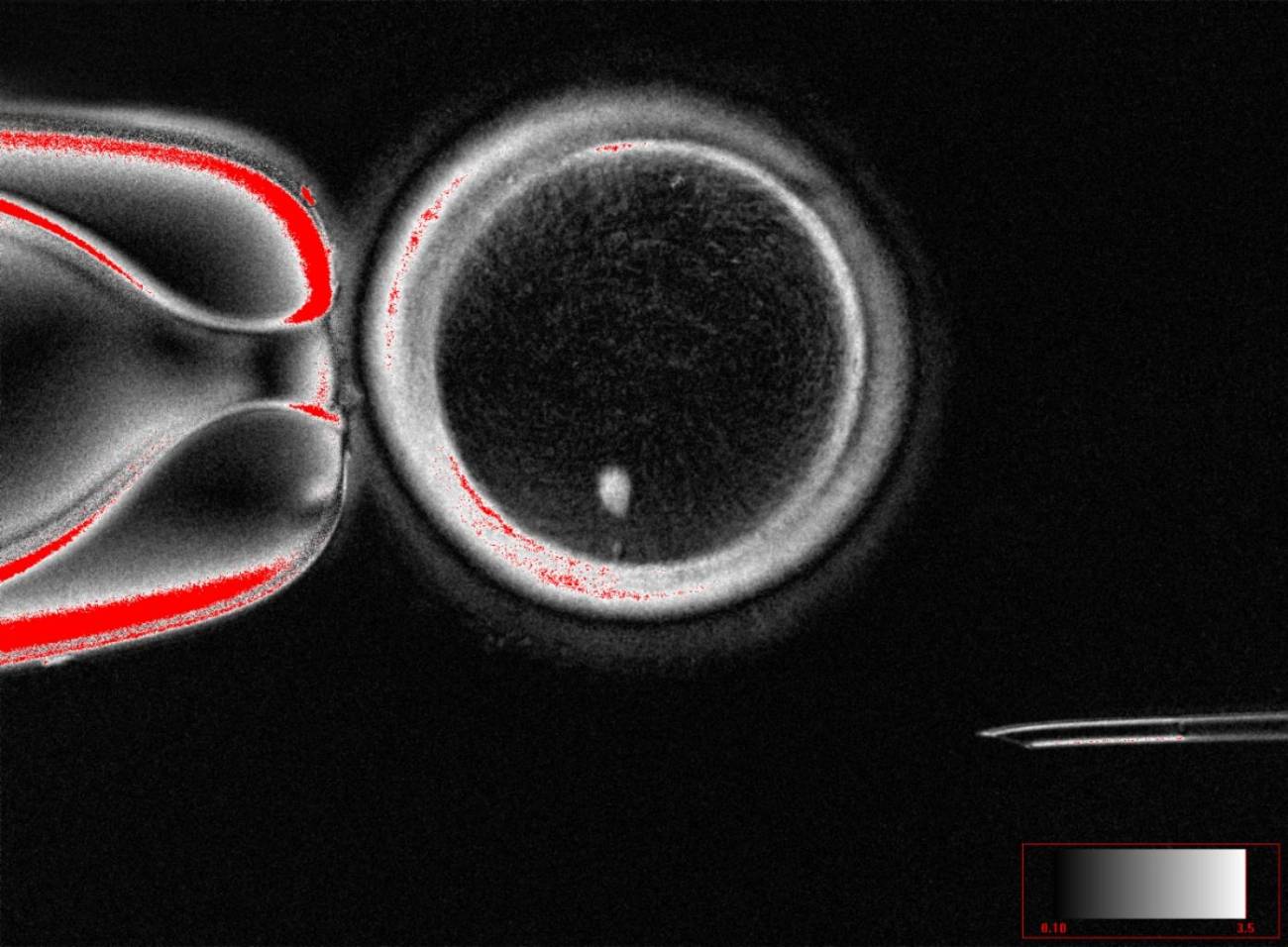
Algunos óvulos creados en el laboratorio fueron fecundados y alcanzaron las primeras fases del desarrollo embrionario. Aunque no prosperaron más allá del sexto día, este estudio demuestra que es posible inducir la formación de gametos humanos mediante reprogramación celular.
La infertilidad afecta a millones de personas en todo el mundo y, en muchos casos, está relacionada con la ausencia de gametos funcionales. En las mujeres, la pérdida de calidad y cantidad de los óvulos a partir de los 35 años es una de las principales causas. La fecundación in vitro convencional no siempre ofrece una solución para quienes carecen de gametos viables, por lo que la investigación busca alternativas
Un equipo de la OHSU (Oregon Health & Science University, EE UU), liderado por Shoukhrat Mitalipov, ha desarrollado una técnica experimental denominada mitomeiosis. El procedimiento consiste en transferir el núcleo de una célula somática —como las de la piel— a un óvulo donado sin núcleo, y provocar que divida su carga genética, imitando los pasos de la meiosis natural.
La primera firmante del estudio es la bióloga española Nuria Martí Gutiérrez, que se incorporó en 2012 al laboratorio de Mitalipov y está especializada en transferencia nuclear de células somáticas y edición genética en la línea germinal.
El equipo obtuvo 82 óvulos funcionales, que fueron fecundados con esperma humano. Un 9 % alcanzó la fase de blastocisto, correspondiente a los primeros seis días.
Según comenta Martí a SINC, este trabajo representa “un primer paso en nuestro objetivo de ayudar a mujeres que no pueden producir sus propios ovocitos a tener descendencia relacionada genéticamente con ellas”.
El experimento permitió obtener 82 óvulos funcionales, que fueron fecundados con esperma humano. Un 9 % alcanzó la fase de blastocisto, correspondiente a los primeros seis días de desarrollo embrionario. Aunque ninguno se cultivó más allá de ese punto, los autores destacan que se trata de una prueba de concepto que demuestra la viabilidad de generar gametos humanos a partir de células somáticas.
La mayoría de los embriones no progresaron y se detectaron anomalías genéticas.
La diferencia principal respecto a trabajos anteriores es que ya no es necesario que las mujeres produzcan al menos un ovocito maduro. “Solo se necesita una célula somática, por ejemplo de la piel”, destaca la investigadora.
Limitaciones
El trabajo también señala importantes limitaciones. La mayoría de los embriones no progresaron y se detectaron anomalías genéticas, lo que obliga a realizar más estudios antes de plantear posibles aplicaciones clínicas.
“Todavía no hemos conseguido que los 23 cromosomas correctos se eliminen al formar el corpúsculo polar”, explica Martí. “Esto ocurre porque, al introducir el núcleo de una célula somática en el óvulo, los cromosomas homólogos no se alinean correctamente en el nuevo huso acromático. Al no producirse ese emparejamiento, la separación durante la división genera muchas alteraciones genéticas (aneuploidías) que impiden el desarrollo normal del embrión”, añade.
En cuanto a las posibles aplicaciones clínicas, Martí señala que “el objetivo final es que mujeres que no pueden producir ovocitos puedan tener descendencia. También podrían beneficiarse parejas del mismo sexo que deseen hijos con vínculo genético con ambos miembros”.
Creo que como mínimo faltan diez años para que pueda haber aplicaciones terapéuticas en humanos
Nuria Martí Gutiérrez, primera firmante (OHSU)
A pesar del avance, advierte que aún queda mucho por resolver. “Además de comprender cómo se alinean los pares de cromosomas para formar ovocitos con la dotación genética adecuada y promover el intercambio de material hereditario, también debemos tener en cuenta el imprinting”, subraya. Este mecanismo epigenético determina qué genes se expresan según si proceden del padre o de la madre, y resulta esencial para el desarrollo embrionario.
“Yo creo que como mínimo faltan diez años para que pueda haber aplicaciones terapéuticas en humanos”, concluye Nuria Martí Gutiérrez.
- El primer atlas celular de la inflamación emplea IA para acelerar el diagnóstico - enero 12, 2026
- La caza de ballenas comenzó en Sudamérica hace 5 000 años, un milenio antes de lo que se creía - enero 9, 2026
- Fósiles hallados en Marruecos podrían ser de ancestros muy cercanos a los humanos modernos - enero 7, 2026