
Madrid, España.
Científicos del Centro Nacional de Investigaciones Cardiovasculares (CNIC) y del Instituto de Investigación Sanitaria Princesa (IIS Princesa) han descifrado, en gran parte, el mecanismo por el cual se incrementa la producción de especies reactivas de oxígeno (ROS) en las etapas tempranas de la hipoxia –disminución aguda de oxígeno–.
Esta información, publicada en Nature, resulta clave para avanzar en el conocimiento de la fisiología celular. Podría ser usada para futuras terapias en el tratamiento de las distintas patologías en las que la hipoxia está involucrada: como un ictus o un paro cardíaco.
La mayoría de las células eucariotas dependen del consumo de oxígeno que se produce a través del sistema de fosforilación oxidativa mitocondrial (OXPHOS) para producir energía, explica José Antonio Enríquez, investigador del CNIC. “Este sistema produce, a partir del oxígeno, las ROS, unas entidades moleculares consideradas hasta hace poco tiempo sustancias tóxicas del metabolismo”.
Sin embargo, en bajas proporciones, estas especies reactivas actúan como señales capaces de impulsar adaptaciones celulares. De esta forma, asegura Enríquez, “en los primeros minutos, tras disminuir las concentraciones de oxígeno, se generan las ROS que ejercen de señalizadores para iniciar la respuesta de adaptación celular a la deficiencia de oxígeno”.
Un mecanismo fundamental
En 2019, el Premio Nobel de Medicina o Fisiología se otorgó a los investigadores que descubrieron el mecanismo por el que se desarrollan respuestas a la hipoxia sostenida en el tiempo, que está mediado por los factores de respuesta a hipoxia (HIF).
Sin embargo, el organismo tiene otras respuestas más rápidas a la hipoxia, que no dependen de HIF, y en las que participan las ROS. El mecanismo preciso por el cual se incrementa la producción de ROS en etapas tempranas de la hipoxia sigue siendo desconocido, pero gracias a este nuevo trabajo se tiene ahora un mejor conocimiento.
“Hemos determinado que el sodio (Na++) que entra en las mitocondrias actúa como un segundo mensajero regulando la función de la mitocondria –en concreto de la cadena de transporte electrónico mitocondrial-CTM– y causando la producción controlada de ROS”, afirma Pablo Hernansanz-Agustín.
Este mecanismo, a través de la producción de ROS, “es fundamental para la adaptación de la circulación sanguínea pulmonar a situaciones de hipoxia mediante la redistribución del flujo de sangre a zonas menos ventiladas, un fenómeno llamado vasoconstricción pulmonar hipóxica”, señala Antonio Martínez Ruiz.
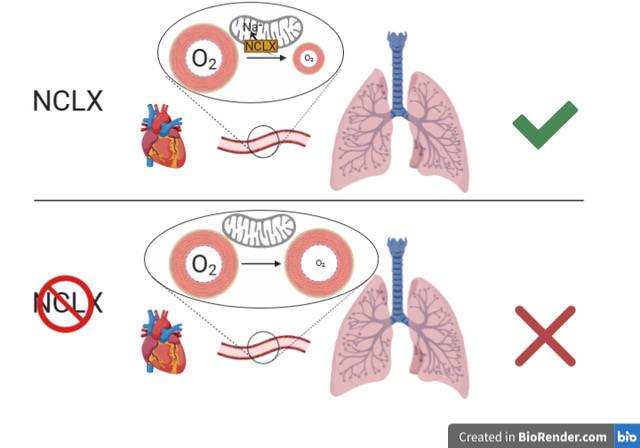
La figura ilustra el papel del intercambiador de sodio por calcio mitocondrial (NCLX) en la adaptación temprana a bajas concentraciones de oxígeno o hipoxia. Esta mediante la introducción de sodio dentro de la mitocondria. Esto se ve ejemplificado en la vasoconstricción hipoxia de la arteria pulmonar, que conecta el corazón con los pulmones.
Ante la bajada de oxigeno se activa el transporte de sodio al interior de las mitocondrias y se inicia la señalización que active la constricción de la arteria. La eliminación del transportador NCLX de la mitocondria impide la correcta respuesta de la arteria a la bajada de oxígeno.
Terapia para distintas patologías
Varios aspectos de esta investigación son claves para la fisiología celular, destacan los investigadores. Primero, la capacidad del sodio mitocondrial de regular la fluidez de membranas celulares, un aspecto desconocido hasta el momento. Este que podría tener grandes implicaciones en la regulación de multitud de procesos celulares.
Segundo, precisa Enríquez, “la relevancia en este proceso de los supercomplejos mitocondriales; genera estructuras sensibles o insensibles al sodio dentro de la cadena de transporte electrónico mitocondrial y permite que la acción del sodio no sea tóxica”.
Además, añade Martínez, la entrada de sodio en la mitocondria viene precedida de una solubilización del calcio. Está depositado dentro de las mitocondrias, en unas estructuras que habían sido descritas hace más de 50 años; pero para las que hasta ahora no se conocía su función fisiológica.
“El trabajo también demuestra que la inhibición del intercambiador mitocondrial de sodio/calcio (NCLX) es suficiente para bloquear esta vía. Evitando la adaptación a la hipoxia”, apunta Enríquez. Podría ser usado como terapia para las distintas patologías en las que la hipoxia está involucrada.
Por: SINC
- Plumas NCC | “Azul & Oro” - abril 17th, 2024
- Plumas NCC | Regulación de la Inteligencia Artificial en México - abril 15th, 2024
- NCC Radio Ciencia – Emisión 254 – 15/04/2024 al 21/04/2024 – En México trabajan en bioplaguicidas con modelado matemático para mitigar los efectos del cambio climático - abril 15th, 2024














